Sommaire
Introduction
Mélange de deux corps
Eau chaude + eau froide
Cycle et rendement de Carnot
Cycle Beau de Rochas
Détente de Joule-Gay Lussac
Mélange d’eau et de glace
Une masse, un piston et du chauffage
Nous allons voir dans ce chapitre quelques exercices d’application classiques de thermodynamique, en particulier du premier principe, qui peuvent être considérés comme du cours.
Tu dois impérativement savoir les refaire car il s’agit d’exemples revenant régulièrement en exercice et en contrôle.
Il est fortement conseillé évidemment d’après au préalable lu le chapitre sur le premier principe avant de faire les exercices ci-dessous.
Énoncé :
On considère une boîte aux parois athermanes initialement séparée en deux parties par une paroi qui ne peut pas glisser mais amovible.
La partie de gauche contient un gaz de masse ma, de température Ta et de capacité calorifique massique ca.
La partie de droite contient un gaz de masse mb, de température Tb et de capacité calorifique massique cb.
On suppose que les gaz ne subissent pas de changement d’état et que leur capacité calorifique ne dépend pas de la température.

On enlève alors la paroi séparatrice (sans que cela n’engendre de travail) : calculez alors la température finale Tf du milieu.
Vérifiez que des cas particuliers sont en accord avec l’expression trouvée.
Solution :
On considère comme système les deux gaz. La paroi étant athermane, il n’y a pas d’échange de chaleur avec l’extérieur, donc Q = 0.
Il y a en revanche des transferts thermiques entre les deux gaz, on notera Q1 celui subi par le gaz de gauche et Q2 celui subi par le gaz de droite.
On a donc Q = Q1 + Q2
D’où Q1 + Q2 = 0
Le gaz de gauche subit un changement de température de Ta à Tf, le gaz de droite subit un changement de température de Tb à Tf, d’où :
\(\textstyle \int\limits_{T_a}^{T_f} m_a c_a dT + \int\limits_{T_b}^{T_f} m_b c_b dT = 0 \)
Les capacités calorifiques étant indépendantes de la température d’après l’énoncé :
\(\textstyle m_a c_a \int\limits_{T_a}^{T_f} dT + m_b c_b \int\limits_{T_b}^{T_f} dT = 0 \)
\(\textstyle m_a c_a (T_f – T_a) + m_b c_b (T_f – T_b) = 0 \)
En isolant Tf, on obtient :
\(\textstyle T_f = \frac{m_ac_aT_a + m_bc_bT_b}{m_ac_a + m_bc_b} \)
On vérifie très facilement que cette formule est bien homogène (tu peux t’entraîner à le faire).
De plus, vérifions comme le demande l’énoncé, que certains cas particuliers sont bien conformes à l’expression trouvée.
Tout d’abord, si Ta = Tb : les températures initiales étant identiques, la température finale ne devrait pas changer.
\(\textstyle T_f = \frac{m_ac_aT_a + m_bc_bT_a}{m_ac_a + m_bc_b} \)
\(\textstyle T_f = \frac{T_a(m_ac_a + m_bc_b)}{m_ac_a + m_bc_b} \)
\(\textstyle T_f = T_a \)
La température finale est bien égale à la température initiale.
2ème cas particulier : si les deux gaz sont les mêmes (ca = cb), en même quantité (ma = mb) mais de température différente : la température finale devrait être la moyenne des 2 températures :
\(\textstyle T_f = \frac{m_ac_aT_a + m_ac_aT_b}{m_ac_a + m_ac_a} \)
\(\textstyle T_f = \frac{m_ac_a(T_a + T_b)}{2m_ac_a} \)
\(\textstyle T_f = \frac{T_a + T_b}{2} \)
On retrouve bien que la température finale est la moyenne des deux températures.
La formule trouvée est donc bien compatible avec ces deux cas particuliers.
On dispose de deux quantités d’eau de masse m1 et m2, de température T1 et T2 et de volume V1 et V2.
On mélange ces deux quantités d’eau dans un troisième récipient.
Donner la température finale du mélange en fonction de m1, m2, T1 et T2, puis en fonction de V1, V2, T1 et T2.
On considère un gaz parfait subissant le cycle de Carnot composé des 4 phases suivantes :
– de 1 à 2 : détente isotherme à la température Tc (Qc)
– de 2 à 3 : détente adiabatique réversible pour amener à la température Tf
– de 3 à 4 : compression isotherme à la température Tf (Qf)
– de 4 à 1 : compression adiabatique réversible pour revenir à la température Tc
1) Tracer le diagramme de Clapeyron correspondant.
2) Calculer le rendement de ce cycle.
3) Montrer qu’il s’agit du rendement maximal pour un moteur appelé rendement de Carnot.
On considère un gaz parfait subissant le cycle Beau de Rochas composé des 4 phases suivantes :
– de 1 à 2 : compression adiabatique réversible pour amener à Vmin
– de 2 à 3 : combustion isochore pour amener à Qc
– de 3 à 4 : détente adiabatique réversible pour amener à Vmax
– de 4 à 1 : refroidissement isochore pour amener à Qc
On définit le taux de compression volumétrique par :
\(\textstyle \alpha = \frac{V_{max}}{V_{min}} \)
1) Tracer le diagramme de Clapeyron correspondant.
2) Calculer le rendement de ce cycle en fonction de α et γ.
Énoncé :
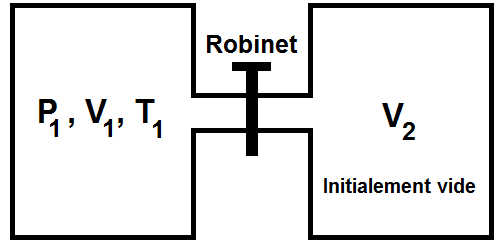
On considère un gaz parfait enfermé dans un récipient de volume V1, à la température T1 et à la pression P1.
Ce récipient est relié à un volume V2 initialement vide par un robinet.
Les parois de l’ensemble sont indéformables et calorifugées.
On ouvre rapidement le robinet, de sorte que le gaz se répartit dans tout le volume.
1) Cette transformation est-elle réversible ?
2) Calculer Q et W échangés avec l’extérieur.
3) En déduire ΔU et la température finale Tf du gaz.
4) Calculer la pression finale Pf du gaz.
Solution :
1) On ouvre rapidement le robinet, donc le gaz se répartit rapidement dans le volume V2 : cette rapidité fait que la transformation est irréversible.
2) Les parois de l’ensemble sont calorifugées d’après l’énoncé, donc Q = 0.
De plus, les parois sont indéformables, donc dV = 0, d’où W = 0.
3) D’après le premier principe, ΔU = W + Q, donc ΔU = 0.
Le gaz étant un gaz parfait, ΔU = CvΔT, donc ΔT = 0.
On a donc Tf = T1.
4) Le gaz étant parfait, on a à l’état initial :
\(\textstyle P_1V_1 = nRT_1 \)
A l’état final, Vf = V1 + V2 et Tf = T1 :
\(\textstyle P_f(V_1 + V_2) = nRT_1 \)
D’où :
\(\textstyle P_f(V_1 + V_2) = P_1V_1 \)
\(\textstyle P_f = \frac{P_1V_1}{V_1 + V_2} \)
La transformation décrite dans l’énoncé est ce que l’on appelle une détente de Joule Gay-Lussac.
Énoncé :
On considère une boîte calorifugée contenant m1 = 200 g d’eau liquide à T1 = 25°C.
On y ajoute un glaçon de masse m2 = 5,00 g à T2 = -10°C.
Calculer la température finale Tf.
Données :
– chaleur latente de fusion de la glace : L = 334 kJ.kg-1
– capacité calorifique massique de l’eau liquide : cliq = 4186 J.kg-1.K-1
– capacité calorifique massique de la glace : cg = 2090 J.kg-1.K-1
Solution :
On considère la système {eau liquide + glace} : les parois étant calorifugées, Q = 0.
Mais il y a transfert thermique entre l’eau et la glace : soit Q1 celui relatif à l’eau liquide et Q2 celui relatif à la glace : Q = Q1 + Q2.
Donc Q1 + Q2 = 0.
Faisons l’hypothèse que la température finale sera supérieure à 0°C : le glaçon va entièrement fondre puis se réchauffer, tandis que l’eau liquide va uniquement subir un refroidissement :
Q1 = m1cliq(Tf – T1)
Pour le glaçon :
– sa température va d’abord augmenter jusqu’à 0°C : m2cg(0 – T2)
– puis il va fondre : m2L
– et ensuite se réchauffer jusqu’à Tf : m2cliq(Tf – 0). On a donc :
Q2 = m2cg(0 – T2) + m2L + m2cliq(Tf – 0)
Q2 = m2(-cgT2 + L + cliqTf)
On regroupe le tout :
\(\textstyle Q_1 + Q_2 = 0 \)
\(\textstyle m_1c_{liq}(T_f – T_1) + m_2(-c_gT_2 + L + c_{liq}T_f) = 0 \)
En isolant Tf, on trouve :
\(\textstyle T_f = \frac{m_1c_{liq}T_1 + m_2(c_gT_2 – L)}{(m_1 + m_2)c_{liq}} \)
En remplaçant avec les données (attention à bien mettre les degrés en Kelvin !), on trouve :
\(\textstyle T_f = 292 K = 19^o C \)
L’hypothèse de départ selon laquelle la température finale était supérieure à 0°C est donc bien vérifiée.
La température trouvée de 19°C est plutôt logique car on mélange un glaçon de 5 g à -10°C avec 200 g d’eau à 25 °C.
On pourrait faire le même exercice mais avec un glaçon plus gros par exemple, et on trouverait alors une température finale négative : l’hypothèse de départ serait alors fausse et il faudrait recommencer en faisant l’hypothèse selon laquelle l’eau liquide va aller à 0°C et une partie va se transformer en glace, et le glaçon va lui aussi aller à 0°C.
Tu peux t’entraîner à faire cet exercice ! 
Les exercices avec masse et piston sont assez courants en thermodynamique. En voici un assez classique, tu pourras trouver des énoncés légèrement différents mais similaires.
Énoncé :
On considère un cylindre aux parois athermanes fermé par un piston. Le piston (en rouge sur le schéma), de section S et de masse négligeable, peut glisser sans frottement entre 2 cales A et B.
Dans l’état initial, le piston est en A, le cylindre renferme un volume VA d’air supposé gaz parfait, à la température extérieure T0, pression P0, (gaz dans l’état 0 : P0, VA, T0).
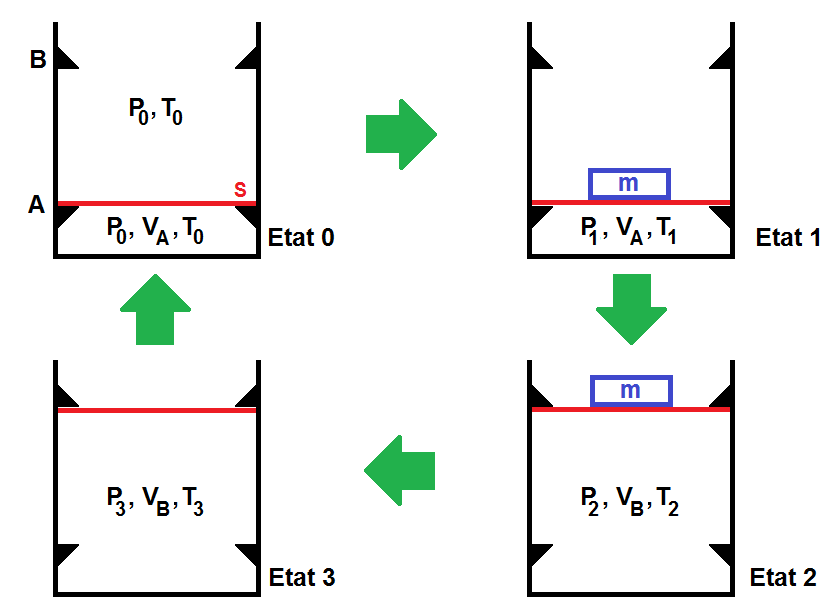
On place une masse m (en bleu sur le schéma) sur le piston et on chauffe très doucement le gaz par un dispositif non représenté sur le schéma, jusqu’à ce que le piston décolle tout juste de la cale A (gaz dans l’état 1 : P1, VA, T1).
On maintient alors le chauffage jusqu’à ce que le piston arrive tout juste en B (gaz dans l’état 2 : P2, VB, T2), le chauffage est alors arrêté.
On enlève alors la masse m et on laisse refroidir l’ensemble jusqu’à ce que le piston décolle tout juste de B (gaz dans l’état 3 : P3, VB, T3). On laisse refroidir jusqu’à la température T0 : le piston revient en A (le gaz est revenu dans l’état 0), le cycle est terminé.
Données : VB = 1,0 L, VA = 330 mL
T0 = 300 K, P0 = 1,0 bar
m = 10 kg, S = 100 cm2, g = 10 m.s-2, R = 8,314 J.K-1.mol-1.
1) Quelle est la caractéristique commune à toutes les transformations ?
2) Quelle est la nature de la transformation de 0 à 1 subie par le gaz ?
3) Exprimer puis calculer la pression P1 et la température T1 en fonction de P0, T0, m, g et S.
4) Quelle est la nature de la transformation de 1 à 2 ?
5) Exprimer et calculer T2 en fonction de T1, VA et VB.
6) Exprimer le travail W1,2 reçu par le gaz lors de cette transformation en fonction de P1, VB et VA.
7) Quelles sont les natures des transformations de 2 à 3 et de 3 à 0 ?
8) Exprimer les travaux W2,3 et W3,0 en fonction de P0, VB et VA.
9) Exprimer puis calculer le travail W échangé par le système avec l’extérieur au cours du cycle, en fonction de m, g, VA, VB, et S. Commenter le signe de W.
10) Tracer l’allure du diagramme de Clapeyron d’un cycle.
11) Retrouver l’expression du travail W avec le diagramme.
Solution :
1) Le piston se déplace sans frottement et les transformations se font lentement, on peut donc supposer qu’elles sont toutes réversibles.
2) La transformation de 0 à 1 subie par le gaz est une isochore (car volume constant) : on peut préciser isochore réversible.
3) Pour cette question, on va utiliser le fait qu’au moment où le piston décolle à peine, il y a équilibre mécanique : la force due à la cale n’est plus prise en compte puisqu’il n’y a plus contact (ce qui n’était pas le cas avant).
Le piston est soumis au poids de la masse (son propre poids est négligeable d’après l’énoncé), aux forces dues à la pression (pression P1 de l’air enfermé qui pousse vers le haut, et pression de l’air P0 dirigée vers le bas).
On avait vu dans le cours que ces forces s’expriment F = P × S, avec S la surface de contact.
D’après la deuxième loi de Newton appliquée au piston :
\(\textstyle \sum \vec{F_{ext}} = \vec{0} \)
En projetant sur l’axe vertical, on obtient :
\(\textstyle P_1S – mg – P_0S = 0 \)
\(\textstyle P_1 = P_0 + \frac{mg}{S} \)
\(\textstyle P_1 = 1,1 \times 10^5 Pa \)
Comme on a P1, avec la loi des gaz parfaits on pourrait trouver T1 mais d’après l’énoncé on ne veut pas le volume VA dans l’expression.
Cependant, on sait que la transformation est isochore, on va donc appliquer la loi des gaz parfait à l’état 0 et à l’état 1 :
\(\textstyle P_0V_A = nRT_0 \)
\(\textstyle P_1V_A = nRT_1 \)
En faisant le rapport des deux équations :
\(\textstyle \frac{T_1}{T_0} = \frac{P_1}{P_0} \)
\(\textstyle T_1 = T_0\frac{P_1}{P_0} \)
On remplace alors P1 par l’expression trouvée précédemment :
\(\textstyle T_1 = T_0(1 + \frac{mg}{SP_0}) \)
\(\textstyle T_1 = 330 K \)
4) La transformation de 1 à 2 est réversible, donc à chaque instant il y a équilibre mécanique, donc la pression du gaz vaut P1. On a ainsi P2 = P1.
La transformation est donc isobare (on peut préciser isobare réversible).
5) D’après la loi des gaz parfaits dans l’état 1 et 2, on a :
\(\textstyle P_1V_B = nRT_2 \)
\(\textstyle P_1V_A = nRT_1 \)
En faisant le rapport des deux équations comme précédemment, on obtient :
\(\textstyle \frac{T_2}{T_1} = \frac{V_B}{V_A} \)
\(\textstyle T_2 = T_1\frac{V_B}{V_A} \)
\(\textstyle T_2 = 1000K \)
6) La transformation est isobare à la pression P1, donc d’après le cours :
\(\textstyle W_{1,2} = -P_1 \Delta V \)
\(\textstyle W_{1,2} = -P_1 (V_B – V_A) \)
7) La transformation de 2 à 3 est isochore car volume constant VB (on peut préciser isochore réversible).
Tout comme à la question 4, la transformation de 3 à 0 est réversible donc à chaque instant il y a équilibre mécanique, donc la pression du gaz vaut P0 (puisqu’elle vaut P0 à l’état 0). La transformation de 3 à 0 est donc isobare.
8) La transformation de 2 à 3 est isochore donc W2,3 = 0.
La transformation de 3 à 0 est isobare à la pression P0, donc de même qu’à la question 6 :
\(\textstyle W_{3,0} = -P_0 \Delta V \)
\(\textstyle W_{3,0} = -P_0 (V_A – V_B) \)
9) Le travail sur tout le cycle est la somme des travaux des différentes transformations, donc :
\(\textstyle W = W_{0,1} + W_{1,2} + W_{2,3} + W_{3,0} \)
W0,1 = 0 car transformation isochore (c’est le seul qui n’était pas demandé dans l’énoncé) :
\(\textstyle W = 0 -P_1(V_B – V_A) + 0 -P_0(V_A – V_B) \)
\(\textstyle W = (P_1 – P_0)(V_A – V_B) \)
\(\textstyle W = \frac{mg}{S}(V_A – V_B) \)
\(\textstyle W = -6,7 J \)
W est négatif : il cède du travail à l’extérieur (plutôt logique car il reçoit de l’énergie sous forme thermique).
10) Le cycle est constitué de deux isochores (0-1 au volume VA et 2-3 au volume VB) qui seront représentées verticalement dans le diagramme de Clapeyron, et de deux isobares (1-2 à la pression P1 et 3-0 à la pression P0) qui seront représentées horizontalement.
De plus, VA < VB et P0 < P1, donc on a :
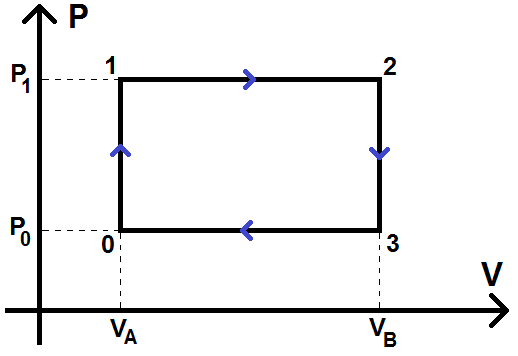
11) Le cycle est décrit dans le sens des aiguilles d’une montre, donc le travail est égal à l’opposé de l’aire du cycle :
\(\textstyle W = -A_{cycle} \)
Or il s’agit d’un rectangle, dont les côtés valent (VB – VA) et (P1 – P0), donc :
\(\textstyle W = -(P_1- P_0)(V_B – V_A) \)
\(\textstyle W = (P_1- P_0)(V_A – V_B) \)
On retrouve bien l’expression trouvée précédemment par le calcul !
Les exercices sur ce chapitre seront bientôt disponibles !
Sommaire des coursHaut de la page



Bonjour,
Serait il possible de préciser la réponse suivante (exercice du piston et de la masse) ?
4) La transformation de 1 à 2 est réversible, donc à chaque instant il y a équilibre mécanique, donc la pression du gaz vaut P1. On a ainsi P2 = P1.
Je ne comprends pas comment affirmer qu’il y a équilibre mécanique, est ce la définition d’une transformation réversible ? Il y a pourtant une force qui pousse le piston vers le haut ?
D’avance merci pour votre retour 🙂
Quand la transformation est réversible, elle est quasi-statique, donc à chaque instant ce sont des micro-équilibres : on considère qu’il y a équilibre à chaque instant.